近日,南京鼓楼医院-魏嘉教授团队、南京大学-李劼教授团队和岩唐生物科技(杭州)有限责任公司合作在Cell Reports Medicine上发表题为“Glycoengineering-based anti-PD-1-iRGD peptide conjugate boosts antitumor efficacy through T cell engagement”的研究论文。该研究揭示基于YTConjuTM糖基偶联技术平台的新型PD-1抗体iRGD肽偶联物的抗肿瘤机制,拓展了肿瘤免疫治疗新思路。
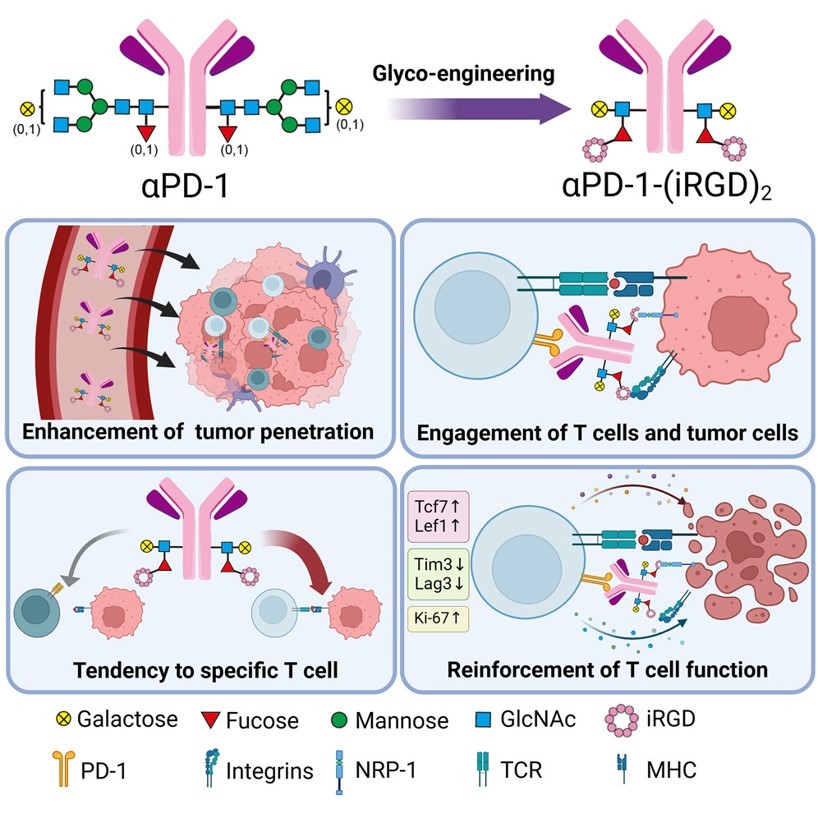
近年来,双特异性T细胞诱导体(BiTEs)由于其独特的抗肿瘤机制和疗效而备受关注。相比于传统抗体,BiTEs对T细胞和肿瘤细胞都有亲和力,能以更低的剂量有效控制肿瘤。然而,传统的靶向CD3的BiTEs仍存在引发系统性细胞因子风暴、免疫检查点分子上调、肿瘤抗原逃逸等缺陷。
在本研究中,研究团队将靶向PD1的抗体和靶向αv整合素的环肽iRGD进行有效组合,提出了一种新型BiETs的设计思路。然而利用传统的融合表达策略,iRGD在真核系统中存在难以完全形成环状结构(经常观察到部分环化)的问题。由此研究团队采用了基于岩藻糖基的偶联策略(YTConjuTM),高效地制备了均一的抗体肽偶联物αPD-1-(iRGD)2。该偶联物具有PD-1及iRGD受体(整合素与NRP-1)的双重亲和力,能够促进PD-1+ T细胞与高表达整合素的肿瘤细胞衔接。与现有的传统BiTEs相比,αPD-1-(iRGD)2介导的桥接作用依赖于pMHC与TCR的特异性识别,避免了非选择性的T细胞激活和过度的TCR信号传导。同时,iRGD作为经典的肿瘤穿透肽,显著提升了αPD-1-(iRGD)2在肿瘤组织内的分布。
在多种肿瘤模型中,相比于αPD-1组,以及αPD-1和iRGD联合给药组,αPD-1-(iRGD)2展示出了更出色的抗肿瘤效应。特别是在免疫浸润较差的“冷肿瘤”模型中,αPD-1-(iRGD)2展现了显著的抗肿瘤效果。流式细胞术分析显示,αPD-1-(iRGD)2显著增加了肿瘤微环境中的CD8+ T细胞数量,并增强了这些T细胞的活性和增殖能力。单细胞测序结果表明,αPD-1-(iRGD)2重塑了肿瘤微环境(TME),并扩增了一群具有独特表型的CD8+ T细胞,这些细胞表达与干细胞和记忆相关的基因(Tcf7、Il7r、Lef1和Bach2)。
南京大学医学院附属鼓楼医院魏嘉教授、南京大学化学化工学院李劼教授是本文的共同通讯作者;南京大学医学院潘云枫博士、南京大学化学化工学院薛琪博士、岩唐生物科技(杭州)有限责任公司杨熠博士为本文的共同第一作者。
原文链接:https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(24)00282-9